Зикадия: инструкция по применению, аналоги, отзывы, цена
Латинское название: Zykadia
Действующее вещество/Аналог: Церитиниб
Код АТХ: L01XE28 Ингибиторы протеинкиназы
Производитель: ООО «Новартис Фарма» (Швейцария)
Рецептурное: Да
Предназначение: Противоопухолевые
Оцените материал:
 Зикадия
Зикадия
Торговое название: ЗИКАДИЯ® (Zykadia)
Международное непатентованное название (МНН) или группировочное наименование: Церитиниб
Регистрационный номер: ЛП-004766 от 29.03.18
Состав
Одна капсула Зикадия содержит:
Действующее вещество: церитиниб – 150,00 мг;
Вспомогательные вещества: целлюлоза микрокристаллическая, гипролоза, карбоксиметилкрахмал натрия, магния стеарат, кремния диоксид коллоидный;
Оболочка капсулы: желатин, титана диоксид (Е171), индигокармин (Е132), чернила черные.
В состав чернил черных входит: шеллак, краситель железа оксид черный (E 172), пропиленгликоль, аммиак водный.
Лекарственная форма Зикадии: капсулы 150 мг
Описание
Твердые желатиновые капсулы № 00 с синей непрозрачной крышечкой и белым непрозрачным корпусом. На крышечке черным цветом нанесена радиальная маркировка «LDK 150MG», на корпусе – черным цветом радиальная маркировка «NVR». Содержимое капсул: порошок белого или почти белого цвета.
Идентификация и классификация
Фармакотерапевтическая группа: Противоопухолевое средство – протеинтирозинкиназы ингибиторы.
КОД АТХ: L01XE28 Ингибиторы протеинкиназы
Фармакологические свойства
Механизм действияЦеритиниб - высокоселективный и мощный ингибитор киназы анапластической лимфомы (anaplastic lymphoma kinase - ALK) для применения внутрь. Церитиниб ингибирует аутофосфорилирование ALK, ALK-опосредованное фосфорилирование сигнальных белков и пролиферацию ALK-зависимых опухолевых клеток как in vitro, так и in vivo.
Транслокация гена ALK приводит к экспрессии образующегося гибридного белка и, как следствие, конститутивной активации ALK-опосредованного сигнального каскада при немелкоклеточном раке легкого (НМРЛ). В большинстве случаев НМРЛ партнером для транслокации ALK является ген EML4. Образующийся химерный белок EML4-ALK содержит домен протеинкиназы ALK, слитый с N-концевой частью EML4. Церитиниб ингибирует киназу EML4-ALK в клеточной линии НМРЛ (H2228), что приводит к подавлению пролиферации клеток in vitro и регрессии опухолей у иммунодефицитных мышей и крыс, несущих ксенотрансплантанты клеточной линии H2228.
Фармакодинамика
Было показано, что церитиниб дозозависимо ингибирует активность ALK-киназы и ALKопосредованную передачу сигналов в линии клеток Karpas 299 (клеточная линия лимфомы) и H2228 (клеточная линия рака легкого). Церитиниб ингибирует пролиферацию опухолевых клеток in vitro и приводит к регрессии опухоли in vivo у мышей и крыс на моделях ксенотрансплантата. Церитиниб подавляет активность киназы ALK приблизительно в 20 раз мощнее, чем кризотиниб: по данным ферментного анализа активность киназы ALK (50 % ингибирующая концентрация (ИК50) при ингибировании ALK составляет 0,15 нмоль для церитиниба и 3 нмоль для кризотиниба. Из киназной панели, состоящей из 36 ферментов, церитиниб ингибировал еще только 2 другие киназы с активностью приблизительно в 50 раз меньшей, чем при ингибировании ALK. Ко всем другим киназам из панели активность церитиниба была в 500 раз меньше по сравнению с ALK, что демонстрирует высокую степень селективности. В фармакодинамическом исследовании применения однократной дозы и исследовании эффективности многократной дозы на опухолевых моделях лимфомы Karpas 299 и рака легкого H2228 было показано, что для достижения регресса опухоли необходимо подавить активность ALK на 60 % - 80 %.
Фармакокинетика
Всасывание Максимальная концентрация в плазме крови (Cmax) церитиниба достигалась приблизительно через 4-6 часов после однократного применения внутрь. Всасывание после применения внутрь оценивалось как ≥ 25 % на основании процентного содержания метаболита в кале. Абсолютная биодоступность церитиниба не установлена. Ежедневный прием церитиниба внутрь приводит к достижению равновесного состояния приблизительно через 15 дней, которое остается стабильным и далее со средним геометрическим соотношением кумуляции 6,2 после 3 недель ежедневного приема.
После приема однократной дозы церитиниба внутрь натощак его экспозиция в плазме, представленная Cmax и AUClast, повышалась пропорционально дозе в диапазоне от 50 до 750 мг. Напротив, после ежедневного повторного приема концентрация перед приемом очередной дозы (Cmin) повышалась в большей степени, чем пропорционально дозе.Влияние пищи на всасывание
Системная экспозиция церитиниба повышается при приеме с пищей. Значение площади под кривой «концентрация-время» (AUC) AUCinf церитиниба было на 58 % и 73 % выше (Cmax приблизительно на 43 % и 41 % выше) у здоровых пациентов, при одновременном однократном приеме 500 мг церитиниба с пищей с низким (330 Ккал и 9 грамм жира) и высоким содержанием жира (1000 Ккал и 58 грамм жира) соответственно, в сравнении с приемом натощак.
По данным исследования по оптимизации дозы с участием пациентов, принимающих церитиниб в суточной дозе 450 мг или 600 мг с пищей (приблизительно 100-500 калорий и 1,5-15 г жира), и пациентов, принимающих церитиниб в суточной дозе 750 мг натощак, не обнаружено клинически значимой разницы в системной экспозиции равновесного состояния церитиниба для групп пациентов (N=36), принимающих церитиниб в дозе 450 мг с пищей, в сравнении с пациентами (N=31), принимающими церитиниб в дозе 750 мг натощак. Отмечалось незначительное снижение равновесного состояния показателей AUC (Доверительный Интервал [ДИ] 90 %) на 4 % (-13 %, 24 %) и Cmax (90 % ДИ) на 3 % (-14 %, 22 %). В то же время, показатели AUC (90 % ДИ) и Cmax (90 % ДИ) в группе пациентов (N=30), принимающих церитиниб в дозе 600 мг с пищей, снизились на 24 % (3 %, 49 %) и 25 % (4 %, 49 %) соответственно в сравнении с группой пациентов, принимающих церитиниб в дозе 750 мг натощак.
Максимальная рекомендуемая суточная доза препарата Зикадия составляет 450 мг внутрь во время приема пищи один раз в день (см. раздел «Способ применения и дозы»).
Распределение
Связь с белками плазмы крови человека in vitro имеет дозозависимый характер от 50 нг/мл до 10000 нг/мл и составляет около 97 %. Объем распределения (Vd/F) составил 4230 л у пациентов после приема внутрь натощак однократной дозы 750 мг препарата Зикадия. Кроме того, церитиниб более предпочтительно распределяется в эритроцитах, по сравнению с плазмой крови, со средним соотношением in vitro кровь/плазма 1,35. Исследования in vitro подтверждают, что церитиниб является субстратом Р-гликопротеина (P-ГП), но не является субстратом белка резистентности рака молочной железы (breast cancer resistance protein - BCRP) или белка множественной лекарственной устойчивости 2 типа (multi-resistance protein 2 - MRP2). Кажущаяся пассивная проницаемость для церитиниба in vitro была определена как низкая. У крыс церитиниб проникал через интактный гематоэнцефалический барьер с соотношением AUCinf головной мозг/плазма крови около 15 %. Отсутствуют данные по соотношению экспозиции головной мозг/плазма крови у человека.
Метаболизм/ Биотрансформация
In vitro исследования демонстрируют, что изофермент CYP3A является основным изоферментом, вовлеченным в метаболический клиренс церитиниба. После приема внутрь натощак однократной дозы 750 мг церитиниб является основным циркулирующим компонентом (82 %) в плазме крови у человека. В общей сложности было обнаружено 11 метаболитов, циркулирующих в плазме крови, средний вклад в радиоактивность по AUC которых составил ≤ 2,3 % для каждого метаболита. Основными путями биотрансформации, обнаруженными у здоровых добровольцев являются монооксигенация, О-дезалкилирование и N-формилирование. Вторичными путями биотрансформации с участием первичных продуктов биотрансформации являются глюкуронирование и дегидрогенизация. Дополнительно наблюдалось присоединение тиольной группы к O-дезалкилированному церитинибу.
Выведение
После приема внутрь натощак однократной дозы церитиниба кажущийся конечный период полувыведения из плазмы крови (T1/2), рассчитанный как среднее геометрическое, варьировал от 31 до 41 часа у пациентов в диапазоне доз от 400 до 750 мг. Средний геометрический показатель кажущегося клиренса (CL/F) церитиниба был ниже в равновесном состоянии (33,2 л/ч) после ежедневного приема внутрь в дозе 750 мг, чем после однократного приема в дозе 750 мг (88,5 л/ч). Таким образом предполагается, что церитиниб демонстрирует нелинейность фармакокинетики с течением времени. Основным путем выведения церитиниба и его метаболитов является выведение через кишечник. Экскреция с фекалиями составляла 91 % вводимой пероральной дозы, при этом 68 % дозы выделялось в виде неизменного церитиниба. Только 1,3 % принятой внутрь дозы выводится почками.
Фармакокинетика у особых групп пациентовВлияние возраста, пола и расы Популяционный фармакокинетический анализ показал, что возраст, пол и раса не
оказывают клинически значимого влияния на экспозицию церитиниба.
Пациенты с нарушением функции печени
Влияние на фармакокинетику после приема внутрь натощак однократной дозы 750 мг церитиниба оценивали у пациентов с исходным нарушением функции печени легкой (N = 8), средней (N = 7) или тяжелой (N = 7) степеней (класс А, В и С по шкале Чайлд-Пью, соответственно) и нормальной функцией печени (N = 8). Средний геометрический показатель системного воздействия (AUCinf) церитиниба был увеличен на 18 % и 2 % у пациентов с нарушениями функции печени легкой и средней степеней тяжести соответственно, по сравнению с пациентами с нормальной функцией печени.
Пациенты с нарушением функции почек
Применение церитиниба у пациентов с нарушением функции почек не изучалось. Тем не менее, доступные данные свидетельствуют о незначительном выведении церитиниба почками (1,3 % от однократной принятой внутрь дозы). При популяционном фармакокинетическом анализе 345 пациентов с нарушением функции почек легкой степени тяжести (клиренс креатинина (КК) от 60 до <90 мл/мин), 82 пациентов с нарушением функции почек средней степени тяжести (КК от 30 до < 60 мл/мин) и 546 пациентов с нормальной функцией почек (КК ≥ 90 мл/мин) во всех группах были продемонстрированы сходные значения экспозиции. Таким образом, у пациентов с нарушением функции почек легкой и средней степеней тяжести коррекции дозы не требуется (см. раздел «Способ применения и дозы»). Пациенты с нарушением функции почек тяжелой степени (КК <30 мл/мин) не были включены в клинические исследования.
Электрокардиография сердцаПотенциал удлинения интервала QT для церитиниба оценивался в 7 клинических исследованиях препарата Зикадия®. Для оценки влияния церитиниба на интервал QT у 925 пациентов были собраны последовательные записи электрокардиограммы (ЭКГ) после приема внутрь натощак однократной дозы 750 мг препарата Зикадия и в равновесном состоянии. При централизованном анализе данных ЭКГ впервые возникшее удлинение интервала QTc> 500 мсек было выявлено у 12 пациентов (1,3 %). У 58 пациентов (6,3 %) отмечалось удлинение интервала QTc на> 60 мсек от исходного значения. Анализ среднего значения данных интервала QTc при средней равновесной концентрации по результатам клинического исследования III фазы показал, что на фоне применения церитиниба в дозе 750 мг натощак верхняя граница увеличения длительности интервала QTc составляет 15,3 мсек (при двустороннем 90 % доверительном интервале (ДИ)). Фармакокинетический/фармакодинамический анализ позволяет предположить, что церитиниб может вызывать дозозависимое удлинение интервала QTc.
Показания к применению
Местнораспространенный или метастатический немелкоклеточный рак легкого, положительный по киназе анапластической лимфомы (ALK).
Противопоказания
Сенсибилизация к церитинибу или к любому иному компоненту препарата Зикадия.
Детский возраст до 18 лет (эффективность и безопасность не доказана).
Беременность и период грудного вскармливания.
С осторожностью
Следует соблюдать осторожность при применении препарата у пациентов с нарушением функции почек тяжелой степени, нарушением функции печени тяжелой степени, синдромом врожденного удлинения QT, удлинением интервала QT, в том числе в анамнезе, или предрасположенностью к удлинению интервала QT, хронической сердечной недостаточностью, брадиаритмией, нарушениями водно-электролитного баланса, а также у пациентов, принимающих антиаритмические и другие препараты, удлиняющие интервал QT, препараты, способные вызывать брадикардию (в том числе бета-адреноблокаторы, недигидропиридиновые блокаторы «медленных» кальциевых каналов, клонидин, дигоксин); у пациентов с гипергликемией, сахарным диабетом и/или принимающих глюкокортикостероиды; при одновременном применении с мощными ингибиторами и индукторами изофермента CYP3A/P-ГП; при одновременном применении с субстратами, метаболизирующимися изоферментом CYP3A, или известными субстратами CYP3A с узким терапевтическим индексом; при одновременном применении с лекарственными средствами, являющимися субстратами изоферментов CYP2А6 и CYP2Е1; при одновременном применении лекарственных средств, являющихся субстратами BCRP; при одновременном применении с лекарственными средствами, влияющими на уровень pH желудочного сока.
Применение при беременности и в период грудного вскармливания
Беременность
Данных по применению препарата Зикадия® у беременных женщин недостаточно. Исследования репродуктивной токсичности (в т.ч. исследования влияния на эмбриофетальное развитие) у животных показали отсутствие фетотоксического или тератогенного действия церитиниба в период органогенеза; однако экспозиция церитиниба в плазме крови матери была несколько ниже экспозиции, наблюдаемой при применении у пациенток вне беременности в рекомендуемых для человека дозах. Потенциальный риск у человека неизвестен.
Период грудного вскармливания
Неизвестно, выделяется ли церитиниб с грудным молоком. Поскольку многие лекарственные препараты проникают в грудное молоко у человека и вследствие возможного развития серьезных нежелательных лекарственных реакций у новорожденных детей/младенцев, следует прекратить грудное вскармливание, либо прекратить лечение препаратом Зикадия, принимая во внимание значимость его применения для матери.
Пациенты с сохраненным репродуктивным потенциалом
Контрацепция Пациенткам с сохраненным репродуктивным потенциалом рекомендуется использовать надежные методы контрацепции (методы, для которых риск зачатия составляет менее 1 %) во время лечения препаратом Зикадия и в течение 3 месяцев после прекращения лечения.
Инфертильность
Формальные доклинические исследования потенциального влияния церитиниба на фертильность не проводились. Потенциальное влияние препарата Зикадия на фертильность мужчин и женщин неизвестно.
Способ применения и режим дозирования
Оптимальный режим дозирования определяет лечащий врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Согласно действующей инструкции лекарственное средство Зикадия предназначено для перорального (внутреннего) приема по следующей схеме: внутрь, во время приема пищи один раз в день ежедневно в одно и то же время. Капсулы следует проглатывать целиком, запивая водой, их нельзя разжевывать или раздавливать.
Лечение препаратом Зикадия следует проводить только под наблюдением врача, имеющего опыт работы с противоопухолевыми препаратами. Перед применением препарата Зикадия у пациентов с НМРЛ следует определить наличие экспрессии ALK с использованием точного валидированного метода.
Рекомендованная доза препарата Зикадия составляет 450 мг один раз в день.
В случае пропуска приема дозы, ее следует принять немедленно, в случае, если до очередного приема осталось более 12 часов.
В случае возникновения рвоты, не следует принимать дополнительную дозу препарата, а только следующую по схеме дозу. Максимальная рекомендуемая суточная доза составляет 450 мг.
Лечение препаратом следует продолжать пока наблюдается клинический эффект.
Коррекция дозы
На основании индивидуальных показателей безопасности и переносимости, может потребоваться временное прекращение применения и/или снижение дозы препарата Зикадия. Если снижение дозы требуется в связи с развитием нежелательных лекарственных реакций (НЛР), не перечисленных в Таблице 1, ежедневную дозу препарата Зикадия необходимо снижать ступенчато на 150 мг. Следует применять стандартные методы диагностики и лечения для как можно более раннего выявления и купирования возможных НЛР.
Применение препарата Зикадия необходимо прекратить при непереносимости однократной дозы 150 мг, принятой вместе с пищей.
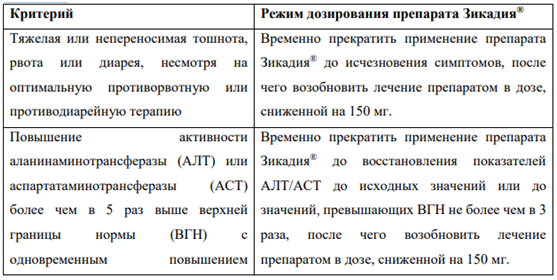
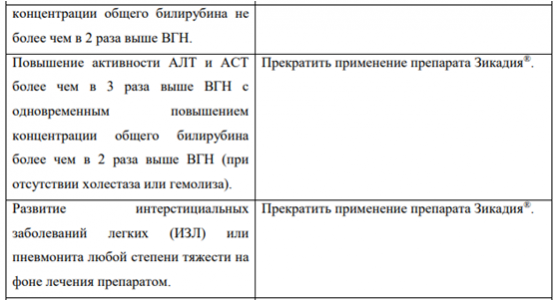
В Таблице 1 суммированы рекомендации по временному прекращению, снижению дозы или прекращению применения препарата Зикадия при выявлении отдельных НЛР.
Таблица 1. Рекомендации по коррекции дозы препарата Зикадия при выявлении отдельных НЛР








 Мощные ингибиторы изофермента CYP3A
Мощные ингибиторы изофермента CYP3A При применении препарата Зикадия следует избегать одновременного применения мощных ингибиторов изофермента CYP3A. Если одновременное применение мощных ингибиторов изофермента CYP3A необходимо, дозу препарата Зикадия следует снизить примерно на одну треть, округлив её до ближайшей, кратной 150 мг. При прекращении применения мощного ингибитора изофермента CYP3A, дозу препарата Зикадия следует вернуть к исходной, применявшейся до начала применения мощного ингибитора изофермента CYP3A.
Особые группы пациентов
Пациенты с нарушением функции почек Не требуется коррекции дозы при применении препарата у пациентов с нарушением функции почек легкой или средней степени тяжести. Вследствие отсутствия опыта применения препарата у пациентов с нарушением функции почек тяжелой степени, необходимо соблюдать осторожность при применении препарата.
Зикадия у пациентов данной категории.
Пациенты с нарушением функции печени Для пациентов с тяжелыми нарушениями функции печени (класс С по шкале Чайлд-Пью) рекомендовано снижение дозы препарата Зикадия® приблизительно на треть, округляя до ближайшего, кратного дозе 150 мг, значения. Не требуется коррекции дозы при применении препарата у пациентов с нарушением функции печени легкой и средней степеней тяжести (класс А и В по шкале Чайлд-Пью соответственно).
Пациенты пожилого возраста (65 лет и старше)
Ограниченные данные по эффективности и безопасности применения препарата Зикадия у пациентов в возрасте 65 лет и старше позволяют предположить отсутствие необходимости коррекции дозы у пациентов данной категории. Отсутствуют доступные данные о применении препарата Зикадия у пациентов в возрасте старше 85 лет.
Побочное действие
Нежелательные лекарственные реакции (НЛР), описанные ниже, отражают применение препарата Зикадия в дозе 750 мг один раз в день натощак у 925 пациентов с ALKположительным распространенным НМРЛ по данным 7 клинических исследований, включая 2 рандомизированных исследования III фазы с активным контролем. Средняя длительность лечения препаратом Зикадия в дозе 750 мг натощак составила 44,9 недель (от 0,1 до 200,1 недель). Необходимость снижения дозы препарата возникла у 62,2 % пациентов, временное прекращение терапии - у 74,8 % пациентов. Частота нежелательных явлений (НЯ), потребовавших отмены препарата Зикадия, составила 12,1 %. Среди НЯ, приводивших к отмене препарата Зикадия, чаще всего (> 0,5 %) отмечались пневмония (0,6 %) и дыхательная недостаточность (0,6 %). Следующие НЛР отмечались у пациентов, принимающих препарат Зикадия в дозе 750 мг натощак с частотой ≥ 10 %: диарея, тошнота, рвота, отклонение лабораторных показателей функции печени от нормы, повышенная утомляемость, боль в животе, снижение аппетита, снижение массы тела, запор, повышение концентрации креатинина в крови, кожная сыпь, анемия, эзофагеальные нарушения. Тяжелые НЛР (3-4 степени тяжести) отмечались у пациентов, принимающих препарат Зикадия в дозе 750 мг натощак с частотой ≥ 5 %: отклонение лабораторных показателей функции печени от нормы, повышенная утомляемость, рвота, гипергликемия, тошнота, диарея.
В исследовании по оптимизации дозы у пациентов с ALK-положительным распространенным НМРЛ, как получавших, так и не получавших лечение, общий профиль безопасности препарата Зикадия, в рекомендуемой дозе 450 мг при приеме совместно с пищей (N = 89) соответствовал профилю безопасности препарата Зикадия в дозе 750 мг при приеме натощак (N = 90), за исключением снижения желудочно-кишечных НЛР, при достижении сопоставимой эффективности. Частота и тяжесть НЛР желудочно-кишечного тракта (диарея 56 %, тошнота 45 %, рвота 35 %; 1,1 % - НЛР 3-4 степени тяжести) были снижены у пациентов, получавших препарат Зикадия в дозе 450 мг при приеме совместно с пищей, по сравнению с дозой 750 мг при приеме натощак (диарея 76 %, тошнота 50 %, рвота – 56 %; 12 % - НЛР 3-4 степеней тяжести). При приеме препарата Зикадия в дозе 450 мг совместно с пищей у 10 % пациентов было зарегистрировано как минимум одно неблагоприятное событие, требующее снижения дозы, и у 42 % пациентов было зарегистрировано как минимум одно неблагоприятное событие, которое требовало временного прекращения приема исследуемого препарата.
Ниже представлены НЛР, возникшие при применении препарата Зикадия® в дозе 750 мг натощак в 7 клинических исследованиях (N=925). Частота отдельных желудочно-кишечных НЛР (диарея, тошнота и рвота) основана на данных пациентов, получавших дозу 450 мг один раз в день совместно с пищей (N = 89). НЛР перечислены в соответствии с классификацией MedDRA. В пределах каждого системно-органного класса НЛР распределены по частоте возникновения в порядке уменьшения частоты. Для оценки частоты использованы следующие критерии: очень часто (≥1/10); часто (от ≥1/100 до <1/10); нечасто (от ≥1/1000 до <1/100); редко (от ≥1/10000 до<1/1000); очень редко (<1/10000); частота неизвестна (не может быть оценена по имеющимся данным).
Нарушения со стороны крови и лимфатической системы: очень часто – анемия; часто – анемия (3-4 степени тяжести). Нарушения со стороны обмена веществ и питания: очень часто – снижение аппетита; часто – гипергликемия, гипофосфатемия, снижение аппетита (3-4 степени тяжести). Нарушения со стороны органов зрения: часто – нарушение зрения1 .
Нарушения со стороны сердца: часто – перикардит2 , брадикардия3 . Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: часто – пневмонит4 .
Нарушения со стороны желудочно-кишечного тракта: очень часто – диарея14, тошнота14 , рвота14, боль в животе5 , запор, эзофагеальные нарушения6 ; часто - диарея (3-4 степени тяжести)14, боль в животе5 (3-4 степени тяжести); нечасто – панкреатит, запор (3-4 степени тяжести), эзофагеальные нарушения6 (3-4 степени тяжести).
Нарушения со стороны печени и желчевыводящих путей: часто – отклонения биохимических показателей функции печени от нормы7 , гепатотоксичность8 ; нечасто – гепатотоксичность8 (3-4 степени тяжести).
Нарушения со стороны кожи и подкожных тканей: очень часто – кожная сыпь9 ; нечасто - кожная сыпь9 (3-4 степени тяжести).
Нарушения со стороны почек и мочевыводящих путей: часто – почечная недостаточность10 , нарушение функции почек11; нечасто - почечная недостаточность10 (3-4 степени тяжести), нарушение функции почек 11 (3-4 степени тяжести).
Общие расстройства и нарушения в месте введения: очень часто - повышенная утомляемость12; часто - повышенная утомляемость12 (3-4 степени тяжести).
Лабораторные и инструментальные показатели: очень часто - отклонение лабораторных показателей функции печени от нормы13, снижение массы тела, повышение концентрации креатинина; часто - снижение массы тела (3-4 степени тяжести), удлинение интервала QT на ЭКГ, повышение активности липазы, повышение активности амилазы; нечасто - повышение концентрации креатинина (3-4 степени тяжести).
Включая случаи в пределах групповых терминов:
1 - Нарушение зрения (ухудшение зрения, нечеткость зрения, фотопсия, плавающие помутнения стекловидного тела, снижение остроты зрения, нарушение аккомодации, пресбиопия)
2 – Перикардит (выпот в полость перикарда, перикардит)
3 – Брадикардия (брадикардия, синусовая брадикардия)
4 – Пневмонит (интерстициальная болезнь легких, пневмонит)
5 – Боль в животе (боль в животе, боль в верхнем отделе живота, дискомфорт в животе, дискомфорт в эпигастральной области)
6 – Эзофагеальные нарушения (диспепсия, гастроэзофагеальная рефлюксная болезнь, дисфагия)
7 - Отклонения биохимических показателей функции печени от нормы (нарушение функции печени, повышение концентрации билирубина в сыворотке крови).
8 – Гепатотоксичность (лекарственное поражение печени, холестатический гепатит, гепатоцеллюлярное поражение печени, гепатотоксичность)
9 – Кожная сыпь (сыпь, акнеформный дерматит, макуло-папулезная сыпь)
10 - Почечная недостаточность (острое повреждение почек, почечная недостаточность)
11 - Нарушение функции почек (азотемия, нарушение функции почек)
12 – Повышенная утомляемость (повышенная утомляемость, астения)
13 - Отклонение лабораторных показателей функции печени от нормы (повышение активности АЛТ, АСТ, гамма-глутамилтрансферазы, концентрации билирубина в крови, активности «печеночных» трансаминаз, активности «печеночных» ферментов, отклонения биохимических показателей функции печени от нормы, повышение биохимических показателей функции печени, повышение активности щелочной фосфатазы)
14 - Частота данных желудочно-кишечных НЛР (диарея, тошнота и рвота) основана на пациентах, получавших рекомендуемую дозу 450 мг один раз в день совместно с пищей (N = 89) в исследовании A2112 (ASCEND-8).
Особые группы пациентов
Пациенты пожилого возраста (65 лет и старше) 168 пациентов (18,2 %) из 925 в возрасте 65 лет и старше принимали препарат Зикадия® в 7 клинических исследованиях. Профиль безопасности препарата у пациентов в возрасте 65 лет и старше был сходным с таковым у пациентов младше 65 лет. Отсутствуют данные по безопасности применения препарата у пациентов старше 85 лет. Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Передозировка
Имеются ограниченные данные о случаях передозировки препарата у человека. В случае передозировки показана поддерживающая и симптоматическая терапия.
Взаимодействие с другими лекарственными средствами
Лекарственные средства, которые могут повышать концентрацию церитиниба в плазме крови Мощные ингибиторы изофермента CYP3A У здоровых добровольцев одновременное однократное применение 450 мг натощак
церитиниба с кетоконазолом (200 мг 2 раза в день в течение 14 дней), мощного ингибитора изофермента CYP3A/P-ГП, приводило к 2,9 и 1,2-кратному повышению AUCinf и Cmax церитиниба, соответственно, по сравнению с применением церитиниба в монотерапии. Согласно результатам моделирования, равновесная AUC церитиниба в более низких дозах при одновременном применении с кетоконазолом 200 мг два раза в день в течение 14 дней не отличается от таковой при применении церитиниба в монотерапии. Следует избегать одновременного применения препарата Зикадия и мощных ингибиторов изофермента CYP3A. При невозможности избежать одновременного применения с мощными ингибиторами изофермента CYP3A, включая, но не ограничиваясь такими лекарственными средствами как ритонавир, саквинавир, телитромицин, кетоконазол, итраконазол, вориконазол, позаконазол и нефазодон, дозу препарата Зикадия следует снизить примерно на одну треть, округлив её до ближайшей, кратной 150 мг. При прекращении применения мощного ингибитора изофермента CYP3A, дозу препарата Зикадия следует вернуть к исходной, применявшейся до начала применения мощного ингибитора изофермента CYP3A (см. раздел «Способ применения»).
Ингибиторы P-гликопротеина Основываясь на данных in vitro, церитиниб является субстратом переносчика Pгликопротеина (P-ГП). В случае применения препарата Зикадия® с лекарственными средствами, ингибирующими P-ГП, возможно повышение концентрации церитиниба. Необходимо соблюдать осторожность при одновременном применении с ингибиторами PГП и тщательно отслеживать развитие НЛР.
Лекарственные средства, которые могут снижать концентрацию церитиниба в плазме крови
Мощные индукторы изофермента CYP3A и P-гликопротеина У здоровых добровольцев одновременное однократное применение 750 мг натощак церитиниба с рифампицином (600 мг в день в течение 14 дней), мощным индуктором изофермента CYP3A/P-ГП, приводило к 70 % и 44 % снижению AUCinf и Cmax церитиниба соответственно по сравнению с применением церитиниба в монотерапии. Одновременное применение препарата Зикадия® с мощными индукторами изофермента CYP3A/P-ГП снижает плазменную концентрацию церитиниба. Следует избегать одновременного приема с мощными индукторами изофермента CYP3A, включая, но не ограничиваясь такими лекарственными средствами как карбамазепин, фенобарбитал, фенитоин, рифабутин, рифампицин, зверобой продырявленный (Hypericum perforatum). Необходимо соблюдать осторожность при одновременном применении с индукторами P-ГП. Лекарственные средства, концентрацию которых может изменять церитиниб Субстраты изоферментов CYP3A и CYP2C9 Основываясь на данных in vitro, церитиниб конкурентно ингибирует метаболизм мидазолама, субстрата изофермента CYP3A, и диклофенака, субстрата изофермента CYP2C9. Наблюдалось также зависящее от времени ингибирование изофермента CYP3A. Одновременное применение однократной дозы мидазолама (чувствительного субстрата изофермента CYP3A), с последующим назначением препарата Зикадия (750 мг/сутки натощак) в течение 3 недель, приводит к 5,4–кратному повышению AUCinf (90% ДИ) церитиниба в сравнении с назначением только мидазолама. Следует избегать одновременного применения препарата Зикадия® прежде всего с субстратами, метаболизирующимися изоферментом CYP3A, или известными субстратами изофермента CYP3A с узким терапевтическим индексом (в т.ч. циклоспорином, дигидроэрготамином, эрготамином, фентанилом, пимозидом, хинидином, такролимусом, алфентанилом и сиролимусом). Если же одновременное применение неизбежно, то рекомендуется снижение дозы субстратов изофермента CYP3A с узким терапевтическим индексом. Одновременное применение однократной дозы варфарина (субстрата изофермента CYP2С9), с последующим назначением препарата Зикадия (750 мг/сутки натощак) в течение 3 недель, приводит к повышению AUCinf S-варфарина (90% ДИ) на 54% (36%, 75%) в сравнении с назначением только варфарина. Следует избегать одновременного применения препарата Зикадия® прежде всего с субстратами, метаболизирующимися изоферментом CYP2C9, или известными субстратами изофермента CYP2C9 с узким терапевтическим индексом (в т.ч. фенитоином и варфарином). Если же одновременное применение неизбежно, то рекомендуется снижение дозы субстратов изофермента CYP2C9 с узким терапевтическим индексом. Необходимо чаще контролировать МНО (международное нормализованное отношение) при неизбежном назначении препарата Зикадия и варфарина, т.к. отмечается повышение антикоагулянтных свойств последнего.
Субстраты изоферментов CYP2A6 и CYP2E1
Основываясь на данных in vitro, церитиниб также ингибирует изоферменты CYP2A6 и CYP2E1 в клинически значимых концентрациях, поэтому церитиниб потенциально может повышать концентрацию в плазме одновременно применяемых лекарственных средств, которые метаболизируются преимущественно этими изоферментами. Необходимо соблюдать осторожность при одновременном применении с лекарственными средствами, являющимися субстратами изоферментов CYP2A6 и CYP2E1 и тщательно контролировать возникновение НЛР. Эффективность контрацептивных средств, принимаемых внутрь, может быть снижена при одновременном применении с церитинибом.
Лекарственные средства, являющиеся субстратами переносчиков
Основываясь на данных in vitro, церитиниб не ингибирует апикальные эффлюксные переносчики MRP2, трансмембранные переносчики в печени OATP1B1 или OATP1B3, трансмембранные переносчики органических анионов в почках OAT1 и OAT3, или трансмембранные переносчики органических катионов OCT1 или OCT2 в клинически значимых концентрациях, поэтому клинически значимое ингибирование церитинибом субстратов данных переносчиков в результате лекарственного взаимодействия маловероятно. Также, основываясь на данных in vitro, предполагается, что в клинически значимых концентрациях церитиниб может ингибировать BCRP и P-ГП в стенке кишечника. В связи с тем, что церитиниб потенциально может повышать концентрацию в плазме крови лекарственных средств, являющихся субстратами BCRP и P-ГП, следует соблюдать осторожность при одновременном применении лекарственных средств, являющимися субстратами BCRP (розувастатин, топотекан, сульфасалазин) и P-ГП (дигоксин, дабигатран, колхицин, правастатин), и тщательно контролировать возникновение НЛР.
Фармакодинамическое взаимодействие
В клинических исследованиях у пациентов, принимавших препарат Зикадия, наблюдались случаи удлинения интервала QTc, поэтому следует соблюдать осторожность при применении препарата у пациентов с удлинением интервала QT, в том числе в анамнезе, или предрасположенностью к удлинению интервала QT, а также у пациентов, принимающих антиаритмические препараты класса I (хинидин, прокаинамид, дизопирамид) или класса III (амиодарон, соталол, дофетилид, ибутилид) или другие препараты, удлиняющие интервал QT, такие как астемизол, домперидон, дроперидол, хлорохин, галофантрин, кларитромицин, галоперидол, метадон, цизаприд и моксифлоксацин. Следует тщательно контролировать продолжительность интервала QT у пациентов данной категории.
Лекарственные средства, влияющие на уровень pH желудочного сока
Лекарственные средства, уменьшающие кислотность желудочного сока (например, ингибиторы протонного насоса, блокаторы H2 – гистаминовых рецепторов, антацидные средства) могут изменять растворимость церитиниба и снижать его биодоступность, т.к. отмечалась зависимость растворимости от уровня pH, при этом происходит уменьшение растворимости церитиниба с увеличением pH in vitro. В клиническом исследовании лекарственного взаимодействия у здоровых добровольцев (N=22) при одновременном применении 750 мг церитиниба однократно натощак и эзомепразола (ингибитора протонного насоса) в дозе 40 мг ежедневно в течение 6 дней отмечалось снижение экспозиции церитиниба (AUCinf и Cmax снижались до 76 % и 79 %, соответственно). Однако, одновременное применение 750 мг церитиниба однократно натощак с ингибитором протонного насоса в течение 6 дней в подгруппе пациентов клинического исследования предполагает меньшее влияние на экспозицию церитиниба в сравнении со здоровыми добровольцами. Так было отмечено снижение AUC (90 % ДИ) на 30 % (0 %, 52 %) и Cmax (90 % ДИ) на 25 % (5 %, 41 %). При этом не отмечено клинически значимого влияния на экспозицию церитиниба в равновесном состоянии при его приеме один раз в сутки. Полученные данные также подтверждает анализ в подгруппах, основанный на результатах трех клинических исследований (N> 400) с участием пациентов как получавших ингибиторы протонного насоса, так и не получавших, продемонстрировавший схожую экспозицию в равновесном состоянии, а также клиническую эффективность и безопасность.
Взаимодействие с пищей/напитками
Препарат Зикадия следует принимать внутрь во время приема пищи. Биодоступность церитиниба повышается при одновременном приеме препарата с пищей. Следует предупредить пациента о необходимости избегать употребления грейпфрута или грейпфрутового сока, поскольку вследствие ингибирования активности изофермента CYP3A в стенке кишечника, возможно повышение биодоступности церитиниба.
Особые указания и меры предосторожности
Гепатотоксичность В клинических исследованиях у 1,1 % пациентов, принимавших препарат Зикадия, наблюдались случаи развития гепатотоксичности (см. раздел «Побочное действие»). Повышение активности АЛТ тяжелой степени (3-4 степеней тяжести) наблюдалось у 25 % пациентов, принимавших препарат Зикадия. По данным клинических исследований у <1 % пациентов наблюдалось повышение активности АЛТ/АСТ более чем в 3 раза выше ВГН с одновременным повышением концентрации общего билирубина более чем в 2 раза выше ВГН при показателях активности щелочной фосфатазы в пределах нормы. В большинстве случаев данные изменения были обратимы при временном прекращении терапии и/или снижении дозы препарата. В нескольких случаях потребовалась отмена препарата Зикадия®. До начала лечения и ежемесячно во время терапии рекомендуется контролировать лабораторные показатели функции печени (включая активность АСТ, АЛТ, концентрацию общего билирубина). По клиническим показаниям при повышении активности «печеночных» трансаминаз следует проводить более частый контроль данных показателей (см. раздел «Способ применения и дозы»).
Интерстициальная болезнь легких (ИЗЛ) / пневмонит
В клинических исследованиях у пациентов, принимавших препарат Зикадия, наблюдались случаи развития тяжелой, жизнеугрожающей или приводящей к смертельному исходу интерстициальной болезни легких/пневмонита (см. раздел «Побочные действия»). Большинство случаев тяжелых, жизнеугрожающих состояний разрешалось или же течение их улучшалось при отмене препарата Зикадия. Следует контролировать состояние пациента с целью выявления симптомов, указывающих на развитие ИЗЛ и/или пневмонита. При выявлении ИЗЛ и/или пневмонита любой степени тяжести на фоне лечения следует исключить другие возможные причины развития ИЗЛ и/или пневмонита и прекратить применение препарата Зикадия (см. раздел «Способ применения и дозы»).
Удлинение интервала QT
В клинических исследованиях у пациентов, принимавших препарат Зикадия, наблюдались случаи удлинения интервала QTc, которое может приводить к желудочковой тахиаритмии (например, к желудочковой тахикардии типа «пируэт») или внезапной смерти (см. раздел «Побочные действия»). При централизованном анализе данных ЭКГ впервые возникшее удлинение интервала QTc > 500 мсек было выявлено у 12 пациентов (1,3 %), у 6 из которых отмечалось увеличение интервала QTc > 450 мсек от исходного значения. У 58 пациентов (6,3 %) отмечалось удлинение интервала QTc на > 60 мсек от исходного значения. Фармакокинетический/фармакодинамический анализ позволяет предположить, что церитиниб вызывает дозозависимое удлинение интервала QTc. Следует избегать применения препарата Зикадия у пациентов с синдромом врожденного удлинения QT, а также соблюдать осторожность при применении препарата у пациентов с удлинением интервала QT, в том числе в анамнезе, или предрасположенностью к удлинению интервала QT, хронической сердечной недостаточностью, брадиаритмией, нарушениями водно-электролитного баланса, а также у пациентов, принимающих антиаритмические и другие препараты, удлиняющие интервал QT. Рекомендуется проводить периодический контроль ЭКГ и содержания электролитов (например, калия) у пациентов данной категории. По клиническим показаниям при возникновении рвоты, диареи, дегидратации или нарушений функции почек следует проводить коррекцию водно-электролитного баланса. Следует прекратить применение препарата Зикадия при удлинении интервала QTc > 500 мсек или более чем на 60 мсек от исходного значения, а также при развитии желудочковой тахикардии типа «пируэт» или полиморфной желудочковой аритмии или при наличии симптомов/признаков развития аритмии тяжелой степени. Необходимо временно прекратить применение препарата Зикадия® у пациентов с удлинением интервала QTc > 500 мсек до восстановления исходных значений или до уменьшения длины интервала QTc < 481 мсек по данным, по крайней мере, двух измерений ЭКГ, а затем возобновить применение препарата Зикадия в дозе, сниженной на 150 мг.
Брадикардия В клинических исследованиях у пациентов, принимавших препарат Зикадия, наблюдались случаи развития брадикардии (см. раздел «Побочные действия»). Следует, по возможности, избегать одновременного применения препарата Зикадия и других препаратов, способных вызывать брадикардию (в том числе бета-адреноблокаторы, недигидропиридиновые блокаторы «медленных» кальциевых каналов, клонидин, дигоксин). Необходимо регулярно контролировать ЧСС и артериальное давление (АД). При возникновении симптомов брадикардии (не являющейся жизнеугрожающей) необходимо временно прекратить применение препарата Зикадия® до их исчезновения или до восстановления ЧСС до 60 уд/мин и более, оценить влияние одновременно применяемых препаратов, способных вызывать брадикардию, и при необходимости снизить дозу препарата Зикадия. Следует прекратить применение препарата Зикадия в случае развития жизнеугрожающей брадикардии, если влияние других препаратов на развитие брадикардии не установлено; однако если установлено влияние других одновременно применяемых препаратов на развитие брадикардии, необходимо временно прекратить применение препарата Зикадия до исчезновения симптомов брадикардии или до достижения ЧСС 60 уд/мин и более, и после коррекции дозы одновременно применяемых препаратов или после их отмены возобновить лечение препаратом Зикадия в дозе, сниженной на 150 мг, с более частым контролем состояния.
Желудочно-кишечная токсичность
Диарея, тошнота и рвота были зарегистрированы в исследовании подбора дозы у 74,2 % из 89 пациентов, получавших препарат Зикадия\ в рекомендуемой дозе 450 мг при приеме совместно с пищей. Данные НЛР в 49,4 % случаях были событиями 1 степени тяжести. У одного пациента (1,1 %) наблюдалась диарея 3 степени тяжести. Семи пациентам (7,9 %) потребовалось временное прекращение применения лекарственного препарата из-за развития диареи или тошноты. Ни один пациент не нуждался в снижении дозы или временном прекращении лечения препаратом Зикадия из-за диареи, тошноты или рвоты. Необходимо контролировать состояние пациента и при необходимости применять стандартные лечебные мероприятия, включая противодиарейные, противорвотные средства, а также инфузионную терапию. При необходимости следует временно прекратить применение или снизить дозу препарата Зикадия. Если рвота возникла во время приема очередной дозы препарата, не следует принимать дополнительную дозу препарата, а следующую дозу принять в соответствии с предписанием (см. раздел «Способ применения и дозы»).
Гипергликемия
В клинических исследованиях менее чем у 10 % пациентов, принимавших препарат Зикадия®, отмечались случаи развития гипергликемии (любой степени тяжести). У 5,4 % пациентов отмечалось развитие гипергликемии 3-й и 4-й степеней тяжести (см. раздел «Побочные действия»). Риск развития гипергликемии выше у пациентов с сахарным диабетом и/или принимающих глюкокортикостероиды. Следует контролировать концентрацию глюкозы в сыворотке крови натощак до начала терапии препаратом Зикадия, а также периодически в процессе лечения по клиническим показаниям. При необходимости следует начать или скорректировать гипогликемическую терапию.
Повышение активности липазы и/или амилазы
В клинических исследованиях у пациентов, получавших препарат, зарегистрированы случаи повышения активности липазы и/или амилазы (см. раздел «Побочные действия»). Следует контролировать активность липазы и амилазы до и во время терапии препаратом Зикадия в соответствии с клиническими показаниями (см. Способ применения и дозы).
Влияние на способность управления транспортными средствами и механизмами
Препарат Зикадия оказывает незначительное влияние на способность управлять транспортными средствами и/или механизмами. Учитывая возможность развития некоторых НЛР при применении препарата Зикадия (повышенная утомляемость, нарушения зрения), пациентам следует соблюдать осторожность при управлении транспортными средствами и/или механизмами.
Форма выпуска
Капсулы 150 мг. По 10 капсул в блистере из ПХТФЭ/ПВХ и алюминиевой фольги. По 5 или 9 блистеров вместе с инструкцией по медицинскому применению в картонной пачке. По 3 пачки с 5 блистерами в мультиупаковке.
Условия хранения
Хранить при температуре не выше 25 ºС.
Хранить в недоступном для детей месте!
Срок годности
2 года.
Не применять препарат после истечения срока годности, указанного на упаковке!
Условия отпуска
Отпускают по рецепту.
Цена Зикадия в аптеках: от 225 000 рублей до 239 800 рублей (150 мг /150 капсул).
Информация о производителе: Зикадия
Контакты для обращений: ООО «Новартис Фарма» (Швейцария)
| 125315, г. Москва, Ленинградский проспект, дом 72, корпус 3 |
| Телефон: +7 (495) 967 12 70 |
|
https://www.novartis.ru/ |
ИНФОРМИРУЙТЕ ВРАЧА О ПОЯВЛЕНИИ У ВАС ЛЮБЫХ, В ТОМ ЧИСЛЕ НЕ УПОМЯНУТЫХ В ДАННОЙ ИНСТРУКЦИИ, НЕЖЕЛАТЕЛЬНЫХ РЕАКЦИЯХ И ОЩУЩЕНИЯХ! А ТАКЖЕ ОБ ИЗМЕНЕНИИ ЛАБОРАТОРНЫХ ПОКАЗАТЕЛЕЙ НА ФОНЕ ПРИЕМА ЛЕКАРСТВЕННОГО СРЕДСТВА!